The International Elbow Working Group has implemented the term Elbow Dysplasia (ED) to describe several developmental abnormalities that involve the elbow joint and resulting in elbow joint arthrosis.1 Developmental elbow abnormalities included in the term elbow dysplasia are: fragmented medial coronoid process (FMCP), ununited anconeal process (UAP), osteochondritis dissecans (OCD) of the medial humeral condyle and elbow incongruity; more than one condition may be present on the same elbow and both elbows may be affected, although pathology may differ between elbows.2
Several large epidemiological studies have examined the genetic basis of elbow dysplasia, which appears to be inherited differently in different breeds. To complicate matters further, there is evidence that the different manifestations of elbow dysplasia could be inherited independently.3 The differences in inheritance suggest that the syndrome that is currently designated as elbow dysplasia is a common end point for a variety of genetic disorders which disturb elbow development through various mechanisms.3 Three mechanisms have been suggested for the development of elbow dysplasia including osteochondrosis (OC),various joint incongruities, and a biomechanical force mismatch across the elbow joint.4 Osteochondrosis, the disturbed endochondral ossification of articular or physeal cartilage, is most likely the underlying cause for all the conditions included in elbow dysplasia.5 Underdevelopment of the trochlear notch with secondary incongruity is postulated by others to be the primary cause.6 In osteochondrosis, normal cartilaginous development and maturation fails in the hypertrophic zone, resulting in thickened cartilage.5 In the elbow joint, articular cartilage involvement results in OCD while non-articular cartilage alterations are assumed to result in FMCP, UAP and elbow incongruity, probably as a result of small growth abnormalities of the long bones making up the elbow joint.7 The cartilaginous growth disturbance is likely to have genetic and environmental, mainly traumatic, and nutritional causes.5 The most important nutritional factors are an excess supply of energy and relative over nutrition with calcium.5 Trauma is usually minimal and associated with hyperactivity or excessive body weight.5 Diagram 1 shows the relationship of the factors included in elbow dysplasia and the development of arthrosis (Figure 1).
| Figure 1. Pathophysiology and interrelationship between elbow dysplasia and elbow arthrosis | 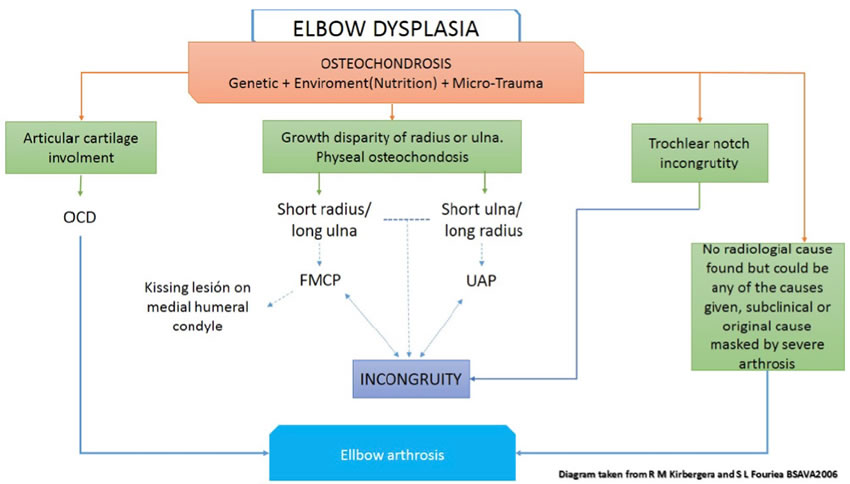
(Taken from Kirberger and Fourie BSAVA 2006). |
|
| |
Radiology Diagnosis
Radiographs are the routine imaging modality practitioners use to diagnose elbow dysplasia. As early osteophytic changes and pathology associated with medial coronoid disease may be subtle, optimal imaging techniques are essential to improve diagnostic accuracy. High-quality, properly positioned radiographs remain the most cost-effective method of diagnosing elbow dysplasia. Radiographs should be obtained with a non-grid table-top technique, low kVp and high mA exposure, and tight collimation; remember to collimate to the joint and not to over collimate on digital systems.8
Radiographs are usually taken in lateral or sternal recumbency. Standard radiographic projections of the elbow include the 90° flexed mediolateral and craniocaudal views. True lateral positioning is important with the X-ray beam centered at the medial epicondyle. For the craniocaudal view, the X-ray beam should be angled 10–15° toward the humerus to best display joint surfaces. The standard mediolateral view (90° flexion) provides good overall evaluation of the MCP and joint congruence but the anconeal process is often obscured by the medial epicondyle. Maximally flexed mediolateral projections (45° inside angle) have the highest sensitivity for UAP and early osteophyte formation and are also recommended for routine screening. However, this view does not contribute to the evaluation of fragmented medial coronoid process (FMCP) when compared to other views. The craniocaudal view is useful for evaluating the medial aspect of the joint for osteochondrosis (OC) or kissing lesions of the trochlea humerus, but fragments of the MCP are rarely demonstrated in this view. A supplemental view that may be useful to highlight OC or FCP lesions is the cranial lateral caudal medial oblique projection because it reduces superimposition with the ulna.8 Sedation or anaesthesia may be indicated for accurate positioning. This is the list of the standard and supplemented views: Routine mediolateral view of the joint (semi-flexed ML), mediolateral view with the joint maximally flexed (flexed ML), mediolateral view with the joint maximally extended and the limb supinated approximately 15° (extended supinated ML = Cd75°MCrLO), craniocaudal view (CrCd), craniolateral to caudomedial oblique views (Cr30°LCdMO), craniomedial to caudolateral oblique view (CrMCdLO).
Radiographic findings: (Figure 2)
 Fragmented medial coronoid process (FMCP):
Fragmented medial coronoid process (FMCP):
The diagnosis is confirmed by seeing the fragment but this is often impossible. The radiological diagnosis is then made based on the presence of secondary arthritic changes, or if the presence of secondary arthritic changes, or if the medial coronoid process cannot be defined clearly or has convex, flattened or irregular outline. "Kissing lesion" at medial humeral condyle. Clinical presentation, age and breed predisposition also need to be taken into consideration.2
 Ununited anconeal process:
Ununited anconeal process:
The radiographic diagnosis can only be made at 5 months of age, or later. We can find radiolucent area on medial humeral condyle with possible sclerotic rim, the humero-anconeal joint space is slightly widened, indicating minor displacement of the anconeal process, and we can find joint incongruity.2
 Osteochondritis dissecans:
Osteochondritis dissecans:
The radiographic diagnosis is possible at 4–5 months of age. We can find radiolucent area on medial humeral condyle with possible sclerotic rim, subchondral saucer defect and flattening of the cranioventral aspect of the medial condyle.2
 Joint incongruity
Joint incongruity
We find joint incongruity in dogs 4 months or older. The radiological changes are step formation between lateral coronoid process and adjacent radial head; medial coronoid process located more proximally; asymmetrical widening of humeroulnar joint, widened humeroradial joint; indistinct outline of trochlear notch and cranial displacement of the humerus towards the cranial radial head margin.2
Figure 2. Best radiological views and radiological changes of elbow dysplasia (taken from RM Kirberger and SL Fourie BSAVA2006).
VIN editor: Figure 2 was not provided at the time of publication.
The osteoarthrosis (OA) is an important topic in a radiographic diagnosis of elbow dysplasia and is characterized by new bone formation at the edges of the joint cartilage. In addition, enthesophytes can be formed; quite typical is the enthesophyte at the caudal margin of the humeral condyle in case of more severe ED. Regardless of the primary cause, the pattern of OA is similar. The different locations where osteophytes and enthesophytes are visible in case of OA are: the proximal surface of the anconeal process, cranial aspect of the radial head, cranial edge of the medial coronoid process, caudal surface of the lateral condylar ridge, sclerosis of the ulnar notch, at the base of the coronoid, on the medial surface of the medial epicondyle and at the medial edge of the medial coronoid process.8
We must consider that an assessment of elbow dysplasia starts from a clinical examination, a complete radiological study which we know we interpret and approach the final diagnosis or to make the decision to perform complementary tests to confirm this.
Bibliography
1. Trostel CT. Canine elbow dysplasia: anatomy and pathogenesis. Compendium. 2003;25(10).
2. Barr FJ, Kirberger RM, eds. BSAVA Manual of Canine and Feline Musculoskeletal Imaging. 2006;8:110.
3. Clements DN. Gene expression in normal and diseased elbows. In: Proceedings of the Autumn Meeting of the British Veterinary Orthopaedic Association, Chester, UK; 2006:6–7.
4. Michelsen J. Canine elbow dysplasia: aetiopathogenesis and current treatment recommendations. The Veterinary Journal. 2013;196:12–19.
5. Nap RC. Pathophysiology and clinical aspects of canine elbow dysplasia. In: Proceedings of the 7th International Elbow Working Group Meeting, Constance, Germany, 1 July 1995: 6–8.
6. Wind AP. Elbow incongruity and developmental elbow diseases in the dog: Part I. Journal of the American Animal Hospital Association. 1986;22:711–724.
7. Olsson SE. Pathophysiology, morphology, and clinical signs of osteochondrosis in the dog. In: Bojrab MS, Smeak DD, Bloomberg MS, eds. Disease Mechanisms in Small Animal Surgery. Second ed. Philadelphia, PA, USA: Lea and Febiger; 1993:777–796.
8. Boroffka SAEB. In: Proceedings of the 29th annual meeting of the International Elbow Working Group (IEWG), Bangkok Thailand, May 17th 2015:19–22.
Diagnóstico Ortopedico de Displasia de Codo por Radiologia
Diana Carolina Villamil González, DVM
Directora de Plataforma de Servicios Veterinarios, Centro de Diagnóstico por Imagen, Manizales, Colombia
El "International Elbow Working Group" ha implementado el termino de displasia de codo (DC) para describir varias anormalidades en el desarrollo que afectan a la articulación del codo y que finalmente resultan en artrosis de la articulación.1 Las anormalidades en el desarrollo del codo incluidas en el término de DC son: fragmentación del proceso coronoides medial (FPCM), no-Unión del proceso ancóneo o proceso ancóneo no unido (NUPA), osteocondritis disecante (OCD) del cóndilo medial del humero e Incongruencia articular del codo; más de una condición puede estar presente en el mismo codo y ambos codos pueden estar afectados, sin embargo la patología puede variar entre codos.2
Grandes estudios epidemiológicos han examinado las bases genéticas de la displasia de codo, la cual parece ser heredada de manera diferente en diferentes razas. Para complicar más las cosas, hay evidencia de que las diferentes manifestaciones de la displasia de codo podrían ser heredadas de forma independiente. Las diferencias en la herencia sugieren que el síndrome que actualmente es diagnosticado como displasia del codo, es un punto común para una variedad de trastornos genéticos que perturban el desarrollo del codo a través de diversos mecanismos.3 Han sido sugeridos tres mecanismos para el desarrollo de displasia de codo incluyendo osteocondrosis (OC), varias incongruencias de la articulación, y un desajuste de la fuerza biomecánica a través de la articulación del codo.4 Es muy probable que la causa subyacente de todas las condiciones incluidas en la displasia de codo sea la osteocondrosis (alteración de la osificación endocondral del cartílago articular o fisis).5 Sin embargo, el subdesarrollo de la escotadura troclear con incongruencia secundaria es postulada por otros como la causa principal.6 En la osteocondrosis, el desarrollo y maduración normal del cartílago falla en la zona hipertrófica, lo que resulta en engrosamiento del cartílago.5 En la articulación del codo, la alteración del cartílago articular termina en OCD, mientras que se asume que las alteraciones no articulares del cartílago terminan en FMCP, UAP y la incongruencia del codo, probablemente como resultado de pequeñas anomalías en el crecimiento de los huesos largos que forman la articulación del codo.7 Probablemente la alteración del crecimiento cartilaginoso tiene causas genéticas y ambientales, principalmente traumáticas y nutricionales. Los factores nutricionales más importantes son un exceso en la oferta de energía y exceso de calcio en la dieta. El trauma es generalmente mínimo y está asociado con la hiperactividad o el sobrepeso.5 El diagrama 1 muestra la relación de los factores incluidos en la displasia de codo y el desarrollo de la artrosis.
Figure 1. Fisiopatología y relación entre displasia de codo y artrosis de codo (tomado de Kirberger RM and Fouriea SL BSAVA2006).
Diagnóstico Radiológico
La radiografía es la imagen diagnóstica de rutina utilizada para diagnosticar la displasia de codo. Tanto los cambios osteofíticos tempranos como la evidencia de la patología asociada a la enfermedad del proceso coronoides medial (PCM) pueden ser sutiles. Se debe considerar que las técnicas óptimas de imagen son esenciales para mejorar la precisión diagnóstica. Las radiografías de alta calidad, correctamente posicionadas, siguen siendo el método más rentable para diagnosticar la displasia de codo. Las radiografías deben ser tomadas con técnica de bajo kVp y alta exposición mAs, y una colimación adecuada; es importante colimar la articulación en la radiografía y no en los sistemas digitales.8
Las radiografías son tomadas usualmente en decúbito lateral y esternal. Las proyecciones radiográficas estándar del codo incluyen las vistas medio-lateral flexionada a 90° y cráneo-caudal. Es importante lograr una posición realmente lateral, con el haz de rayos x centrado en el epicóndilo medial. Para la vista cráneo- caudal, el haz de rayos x debe estar angulado entre 10° y 15° hacia el húmero, para una mejor visualización de las superficies de la articulación. La vista medio- lateral estándar (flexión de 90°) proporciona una buena evaluación global del PCM y la congruencia de la articulación, pero el proceso ancóneo es a menudo opacado por el epicóndilo medial. La proyección medio- lateral con máxima flexión (ángulo interno de 45°) tiene la mayor sensibilidad para la NUPA y la formación de osteofitos temprana, y también se recomienda para los estudios de rutina. Sin embargo, esta vista no contribuye a la evaluación de la fragmentación del proceso coronoides medial (FPCM) cuando se compara con otras vistas. La proyección craneocaudal es útil para evaluar el aspecto medial de la articulación en busca de osteocondrosis (OC) o "kissing lesions" ("lesión del beso") de la tróclea del húmero, pero los fragmentos del PCM rara vez se ponen de manifiesto en esta vista. Una vista complementaria que puede ser útil para resaltar las lesiones de OC o FCP es la proyección Caudomedial oblicua ya que reduce la superposición con el cúbito.8 Para lograr una posición adecuada, se puede usar sedación o anestesia. Esta es la lista de las vistas estándar y complementarias:2
 Medio-Lateral (semiflexionada)
Medio-Lateral (semiflexionada)
 Medio-Lateral con máxima flexión
Medio-Lateral con máxima flexión
 Medio-Lateral con articulación extendida y el miembro en supinación de 15° (Cd75°MCrLO)
Medio-Lateral con articulación extendida y el miembro en supinación de 15° (Cd75°MCrLO)
 Cráneo-Caudal
Cráneo-Caudal
 Cráneo-Lateral-Caudomedial (Cr30°LCdMO)
Cráneo-Lateral-Caudomedial (Cr30°LCdMO)
 Cráneo-medial-caudolateral (CrMCdLO).
Cráneo-medial-caudolateral (CrMCdLO).
Hallazgos radiográficos:
 Fragmentación del proceso coronoides medial (FMCP):
Fragmentación del proceso coronoides medial (FMCP):
El diagnóstico se confirma al ver el fragmento, pero esto es a menudo imposible. El diagnóstico radiológico se hace entonces en base a la presencia de cambios artríticos secundarios, o si el proceso coronoides medial no está claramente definido, tiene contorno convexo, aplanado o irregular. También se pude visualizar la "lesión del beso" o "Kissing lesion" en el cóndilo medial del húmero. La presentación clínica, la edad y la predisposición de la raza también deben ser tenidas en consideración.2
 No-unión del proceso ancóneo:
No-unión del proceso ancóneo:
El diagnóstico radiográfico sólo puede hacerse a los 5 meses de edad, o más tarde. Podemos encontrar una zona radiolúcida en el cóndilo humeral medial con un posible borde esclerótico, el espacio de la articulación húmero-ancónea presenta ligera ampliación, indicando menor desplazamiento del proceso ancóneo y pudiendo encontrar incongruencia articular.2
 Incongruencia articular:
Incongruencia articular:
Encontramos incongruencia articular en perros de 4 meses o más. Los cambios radiológicos incluyen la formación de un "escalón" entre la apófisis coronoides lateral y la cabeza del radio adyacente, el proceso coronoides medial se encuentra en una localización más proximal. Se evidencia ensanchamiento asimétrico de la articulación humerocubital, ensanchamiento de la articulación humeroradial, contorno irregular de la escotadura troclear y el desplazamiento craneal del húmero hacia el margen craneal de la cabeza del radio.2
La osteoartrosis (OA) es un tema importante en el diagnóstico de displasia de codo, que se caracteriza por la neoformación ósea en los bordes del cartílago articular. Adicionalmente, los entesiofitos se pueden formar rápidamente en el margen caudal del cóndilo humeral en casos más severos de DC. Independientemente de la causa primaria, el patrón de OA es similar. Los diferentes lugares en que son visibles los osteofitos y entesiofitos en caso de OA son: la superficie proximal del proceso ancóneo, el aspecto craneal de la cabeza del radio, el borde craneal del proceso coronoides medial, la superficie caudal de la cresta del cóndilo lateral, la superficie medial del epicóndilo medial y el borde medial del proceso coronoides medial con esclerosis de la escotadura cubital.8
Debemos tener en cuenta que una evaluación de displasia de codo comienza a partir de un examen clínico, un estudio radiológico completo que podamos interpretar y así acercarnos a un diagnóstico final o tomar la decisión de realizar pruebas complementarias para confirmarlo.
Bibliografia
1. Trostel CT. Canine elbow dysplasia: anatomy and pathogenesis. Compendium. 2003;25(10).
2. Barr FJ, Kirberger RM, eds. BSAVA Manual of Canine and Feline Musculoskeletal Imaging. 2006;8:110.
3. Clements DN. Gene expression in normal and diseased elbows. In: Proceedings of the Autumn Meeting of the British Veterinary Orthopaedic Association, Chester, UK; 2006:6–7.
4. Michelsen J. Canine elbow dysplasia: aetiopathogenesis and current treatment recommendations. The Veterinary Journal. 2013;196:12–19.
5. Nap RC. Pathophysiology and clinical aspects of canine elbow dysplasia. In: Proceedings of the 7th International Elbow Working Group Meeting, Constance, Germany, 1 July 1995: 6–8.
6. Wind AP. Elbow incongruity and developmental elbow diseases in the dog: Part I. Journal of the American Animal Hospital Association. 1986;22:711–724.
7. Olsson SE. Pathophysiology, morphology, and clinical signs of osteochondrosis in the dog. In: Bojrab MS, Smeak DD, Bloomberg MS, eds. Disease Mechanisms in Small Animal Surgery. Second ed. Philadelphia, PA, USA: Lea and Febiger; 1993:777–796.